Multiple Sklerose (MS) ist eine chronisch entzündliche Erkrankung, die das Gehirn und das Rückenmark betrifft. Die Krankheit ist durch eine Aktivierung des Immunsystems gekennzeichnet und führt zu fortschreitenden neurologischen Beeinträchtigungen. Ein Schwerpunkt liegt auf der Rolle der B-Zellen, die erfolgreich von monoklonalen Antikörpertherapien anvisiert werden, insbesondere im frühen schubförmig remittierenden Stadium der MS und bei aktiven Patienten mit primär progredientem Verlauf.
Eine verstärkte Entzündung in den Hirnhäuten steht in Verbindung mit ausgeprägter Schädigung der grauen Substanz in der Großhirnrinde und einem schwereren Krankheitsverlauf bei einem erheblichen Teil auch sekundär chronisch progredienter MS (SPMS)-Fälle. Es ist nicht klar, ob diese Beziehung auch auf die Rückenmarkspathologie zutrifft. Reali et al. untersuchten in einer Studie den Zusammenhang zwischen immunologischen Infiltraten in den Hirnhäuten und im Gewebe mit der Rückenmarksschädigung bei SPMS-Fällen, die durch das Vorhandensein (F+) oder das Fehlen (F−) von lymphoiden Strukturen in den Hirnhäuten der Großhirnrinde gekennzeichnet sind. Querschnittsschnitte des Hals-, Brust- und Lendenmarks von 22 SPMS-Fällen und fünf Kontrollfällen wurden auf CD20+ B-Zellen, CD4+ und CD8+ T-Zellen, Mikroglia/Makrophagen (IBA-1+), Demyelinisierung (Myelin-Oligodendrozyten-Glykoprotein+) und Axondichte (Neurofilament-H+) analysiert. Lymphoide Strukturen, die follikuläre dendritische Zellnetzwerke und teilende B-Zellen enthielten, wurden im Rückenmark der Leptomeningen von 3 von 11 F+ SPMS-Fällen beobachtet. Die Anzahl von CD4+ und CD20+ Zellen war bei F+ SPMS im Vergleich zu F− SPMS und Kontrollen erhöht, während der Axonverlust bei F+ SPMS am stärksten in den motorischen und sensorischen Bahnen war. Die Dichte von CD20+ B-Zellen in den leptomeningalen Hirnhäuten korrelierte mit CD4+ T-Zellen und der Gesamtzahl von B- und T-Zellen in den Hirnhäuten, der Dichte von perivaskulären CD20+ und CD4+ Lymphozyten im weißen Hirngewebe, der Größe der Läsionen im weißen Hirngewebe und dem Ausmaß des Axonverlusts ausschließlich bei F+ SPMS-Fällen.
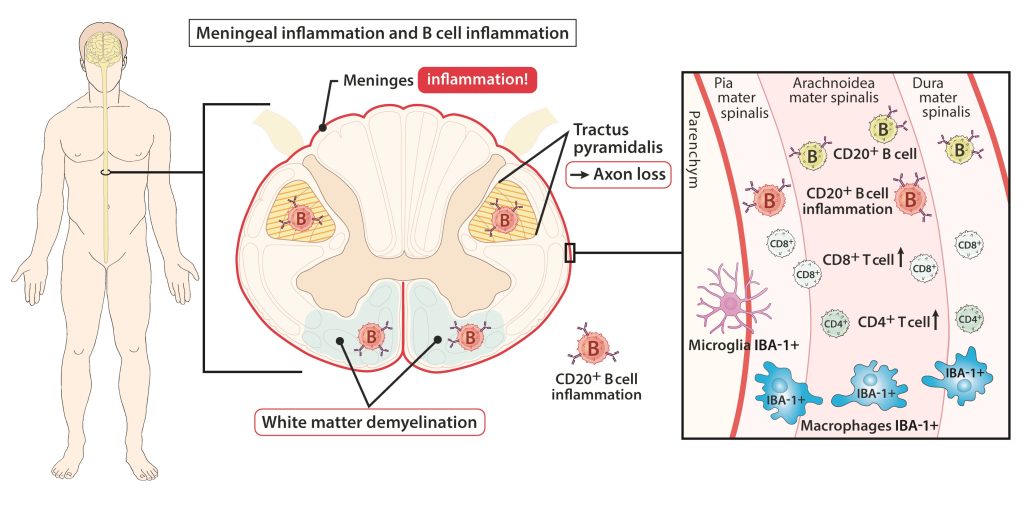
Trotz aller Einschränkungen zeigt die Arbeit, dass das Vorhandensein von lymphoiden Strukturen in den Hirnhäuten mit einer tiefgreifenden Rückenmarkspathologie in Verbindung steht und eine lokale entzündungsreiche B-Zell- getriggerte Affektion der Meningen mit dem Ausmaß der Rückenmarkspathologie zusammenhängt. Daher unterstützt die Arbeit die zentrale Rolle von B-Zellen bei der Aufrechterhaltung von Entzündung und Gewebeschädigung im gesamten Zentralnervensystem im progressiven Krankheitsstadium.
Multiple Sclerosis (MS), a neurodegenerative disease affecting the brain and spinal cord. The disease is characterized by activation of the immune system and leads to accumulating neurological disabilities. One focus is the role of B cells, which are targeted successfully by monoclonal antibody therapies, particularly in the early relapsing-remitting stage of MS and in active primary progressive patients.
B cell aggregates are found in the brain’s leptomeninges and are associated with sites of demyelination and neurodegeneration. However, it is unclear whether such B cell aggregates exist in other areas like the spinal cord, which is also critically involved in MS pathology. The spinal cord shows significant demyelination and neurodegeneration, correlating with clinical disease severity. Leptomeningeal inflammation involving various immune cells is common in MS and may play a role in disease progression.
Increased inflammation in the cerebral meninges is associated with extensive subpial cortical grey matter pathology in the forebrain and a more severe disease course in a substantial proportion of secondary progressive multiple sclerosis (SPMS) cases. It is not known whether this relationship extends to spinal cord pathology. Reali et al. assessed the contribution of meningeal and parenchymal immune infiltrates to spinal cord pathology in SPMS cases characterized in the presence (F+) or absence (F−) of lymphoid-like structures in the forebrain meninges. Transverse cryosections of cervical, thoracic and lumbar cord of 22 SPMS and five control cases were analyzed for CD20+ B cells, CD4+ and CD8+ T cells, microglia/macrophages (IBA-1+), demyelination (myelin oligodendrocyte glycoprotein+) and axon density (neurofilament-H+). Lymphoid-like structures containing follicular dendritic cell networks and dividing B cells were seen in the spinal meninges of 3 out of 11 F+ SPMS cases. CD4+ and CD20+cell counts were increased in F+ SPMS compared to F− SPMS and controls, whilst axon loss was greatest in motor and sensory tracts of the F+ SPMS cases. The density of CD20+ B cells of the spinal leptomeninges correlated with CD4+ T cells and total B and T cells of the meninges; with the density of white matter perivascular CD20+ and CD4+ lymphocytes; with white matter lesion ares; and the extent of axon loss in F+ SPMS cases only.
With all limitations the paper shows that the presence of lymphoid-like structures in the forebrain is associated with a profound spinal cord pathology and local B cell rich meningeal inflammation associates with the extent of cord pathology. Therefore the work supports a principal role for B cells in sustaining inflammation and tissue injury throughout the CNS in the progressive disease stage.
B cell rich meningeal inflammation associates with increased spinal cord pathology in multiple sclerosis. Reali C, Magliozzi R, Roncaroli F, Nicholas R, Howell OW, Reynolds R. Brain Pathol. 2020 Jul;30(4):779-793. doi: 10.1111/bpa.12841.

